Физические и химические свойства простых веществ элементов главных подгрупп
Задача 775.
Каковы общие закономерности изменения физических и химических свойств простых веществ, образуемых элементами главных подгрупп периодической системы элементов: а) в периоде; б) в группе?Решение:а) в периоде.
В периодах (слева направо) — заряд ядра возрастает, число электронных уровней не меняется и равно номеру периода, число электронов на внешнем слое возрастает, радиус атома уменьшается, восстановительные свойства уменьшаются, окислительные свойства возрастают, высшая степень окисления растет от +1 до +7, низшая степень окисления растет от -4 до +1, металлические свойства веществ ослабевают, неметаллические свойства — усиливаются. Это связано с увеличением числа электронов на последнем слое. В периодах слева направо у высших оксидов и их гидратов основные свойства уменьшаются, а кислотные увеличиваются.
б) в группе.
В главных подгруппах (сверху вниз) — заряд ядра возрастает, число электронных уровней возрастает, число электронов на внешнем слое не меняется и равно номеру группы, ради-ус атома увеличивается, восстановительные свойства увеличиваются, окислительные свойства уменьшаются, высшая степень окисления постоянна и равна номеру группы, низшая степень окисления не изменяется и равна (- №группы), металлические свойства веществ усиливаются, неметаллические свойства — ослабевают.. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные. В каждой главной подгруппе ( кроме VIII) сверху вниз усиливается основной характер оксидов и гидроксидов, кислотные же свойства ослабевают.
Это связано с увеличением числа электронных слоёв, а следовательно с уменьшением сил притяжения электронов последнего слоя к ядру.
Кислотно-основные свойства оксидов и гидроксидов элементов
Задача 776.
Как изменяются кислотно-основные и окислительно-восстановительные свойства высших оксидов и гидроксидов элементов с ростом заряда их ядер: а) в пределах периода; б) в пределах группы?Решение:
а) В пределах периода с ростом заряда ядер атомов элементов кислотно-основные свойства их высших оксидов изменяются следующим образом, уменьшается способность к образованию кислот. Изменение кислотно-основных свойств по периоду хорошо можно проследить на примере следующих соединений элементов третьего периода:
Окислительно-восстановительные свойства по периодам с ростом зарядов атомов элементов изменяются следующим образом, ослабевают восстановительные и усиливаются окислительные свойства элементов. Например, в третьем периоде восстановительная способность уменьшается в последовательности: Na2O, MgO, Al2O3, SiO2, P2O5, а окислитель-ная способность растёт в последовательности: NaOH, Mg(OH)2, Al(OH)3, H3PO4, H2SO4, HClO4. Кислотно-восстановительные свойства элементов зависят от числа проявленных ими степеней окисления. По периоду число проявленных элементами степеней окисленности закономерно возрастают: Na проявляет две степени окисленности (0 и +1), Cl – семь (0, -1, +1, +3, +4, +5, +6, +7).
б) В группах с ростом зарядов ядер атомов элементов кислотно-основные свойства оксидов и гидроксидов элементов изменяются следующим образом, усиливаются основные свойства и ослабевают кислотные. Например, в группах электроположительных элементов нарастает сила оснований: Ве(ОН)2 является амфотерным соединением, а Ва(ОН)2 — сильное основание. По группам с ростом зарядов атомов элементов восстановительная способность высших оксидов и гидроксидов элементов нарастает, а окислительная — уменьшается, например, у элементов VII-й группе (HClO4, HBrO4, HIO4) самый сильный восстановитель HClO4, а самый слабый — HIO4. Во II-й группе (ВеО, MgO, CaO, SrO, BaO) самым сильным восстановителем является ВаО, а самым слабым – ВеО.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Разделение таблицы
Как быстро выучить таблицу Менделеева? Опытные педагоги советуют собственноручно разделить ее на части. Многие таблицы уже разбиты на категории, которые включают в себя разные виды элементов. Как правило, такие категории обозначаются различными цветами. Однако школьник может создать удобный для запоминания шаблон собственными силами, так материал лучше отложится в памяти.

К примеру, можно скомпоновать элементы по тяжести, расположить их, двигаясь от простейших к сложным. Можно также учить таблицу по столбцам или строкам. Главное, чтобы пользоваться новым шаблоном было комфортно.
Хватит ли года, чтобы понять все темы с 7 по 11 класс
Год – это достаточный срок, чтобы разобраться по всех разделах химии. 5 рекомендаций школьникам, как изучать химию:
- Выучите периодическую систему Менделеева – разберитесь, в какой последовательности расположены элементы в таблице, что означают цифры и обозначения у каждого вещества и т. д.
- Запомните основные термины и понятия – электролитическая диссоциация, валентность, окислительно-восстановительные реакции, гидролиз, электролиз и др.
- Ищите примеры химических явлений в повседневной жизни. Узнайте, какие безопасные опыты можно проводить в домашних условиях из подручных средств.
- Занимайтесь не только по учебникам. При обучении вам помогут научно-популярные видео на Youtube, статьи в журналах и пр.
- Сначала разберитесь с теорией, а затем приступайте к практике. Если вы неоднократно допускаете одну и ту же ошибку в заданиях, значит, плохо понимаете тему – еще раз прочитайте параграф, посмотрите примеры задач, при необходимости обратитесь за помощью к старшим, например, к преподавателю.
Выучить школьный предмет за год легче всего на онлайн-курсах – многие из них длятся с сентября до мая-июня. На занятиях помогут понять химию, подготовят к ОГЭ 9 класса или к ЕГЭ. Например, в онлайн-школе «Фоксфорд» есть углубленные программы, подготовительные и просто развивающие кругозор, например, «Эксперименты и химия вокруг нас».
Чем хороша мнемотехника
Подходит для любой цели. Вы можете запоминать иностранную лексику и географические карты, шахматные партии и исторические даты, классификации по биологии и формулы из тригонометрии. Словарные слова, определения, стихотворения и целые тексты дословно. Никаких ограничений ни в качестве, ни в количестве информации.
Обеспечивает «феноменальную память». Мнемотехника не требует от вас каких-либо способностей — это навыки, которые легко тренируется в любом возрасте.
Тренирует мозг
Запоминание через образы развивает воображение и улучшает внимание
Работает сразу. Все техники просты и понятны и дают мгновенный результат. Вы сами в этом убедитесь через пару минут.
Мы все используем мнемотехнику с детства.
Помните присказку про каждого охотника, желающего знать, где сидит фазан, с которой мы навсегда запомнили порядок радужных цветов? Или песенку, которая помогла выучить последовательность нот: «ДО — воробышка гнезДО, РЕ — деревья во двоРЕ…». А как мы учили падежи: «Иван родил девчонку, велел тащить пелёнку», — или правописание наречий: «Уж замуж невтерпёж». А пифагоровы штаны и крысу-биссектрису?
Всё это — приёмы мнемотехники, так называемые мнемостихи, акростихи и мнемофразы. Они не самые действенные, так как применимы для узких задач, но с их помощью мы воспроизводим нужную информацию даже спустя десятилетия. В этом весь смысл мнемотехники — запоминать легко, а забыть трудно.
Маленькие хитрости
Таблица Менделеева включает в себя более сотни элементов, поэтому приступать к ее запоминанию стоит заблаговременно. Почему бы не повесить материал над рабочим столом задолго до того, как его знание действительно понадобится? Ежедневно наблюдая названия химических элементов, школьник автоматически будет запоминать их. Это пригодится, когда придется приступить к изучению таблицы всерьез.
Вовсе не обязательно запоминать новые элементы, созданные человеком. Большинство учителей не требует этого. Речь идет о наделенных повышенной радиоактивностью элементах, представляющих серьезную опасность (после 112). Также полезно время от времени заставлять себя выполнять контрольные работы, проверяя полученные знания. Задания можно найти в учебниках или в интернете.
Исследование химических элементов второго столбца периодической таблицы
Используя периодическую систему, исследуйте в этом эксперименте зависимость между готовностью щелочноземельных металлов вступать в реакцию и их местом во втором столбце таблицы.
Что нам понадобится:
- магний,
- кальций,
- стронциевая
стружка, - мерный
цилиндр объёмом 50 мл, - 5 лабораторных
стаканов объемом 100 мл, - весы,
- 3 лабораторных
стакана объемом 50 мл, - таймер,
- уксус,
- универсальный
индикаторный раствор, - деионизированная
вода, - пинцет,
- 3 помощника.
Ход эксперимента:
- Налейте
35 мл деионизированной воды в каждый из
3 лабораторных стаканов объемом 50 мл. - Добавьте
по 20 капель универсального индикаторного
раствора, по 5 капле уксуса во все 3
стакана. Перемешайте. - Поместите
2 больших кусочка кальция в первый
лабораторный стакан объемом 100 мл. - Поместите
2 кусочка магния такого же размера во
второй стакан объемом 100 мл. - Поместите
2 кусочка стронция такого же размера в
последний стакан объемом 100 мл. - Ваша задача
– засечь время на следующем шаге. - Трем
помощникам нужно одновременно вылить
получившийся раствор из стаканов
объемом 50 мл в стаканы объемом 100 мл с
металлами. - Вы должны
записать время, на протяжении которого
содержание каждого стакана стало
фиолетовым. - Если
какой-то из металлов будет менять цвет
более 5 минут, можно остановить время
и записать 5+. - Теперь вы
знаете, какой из металлов реагирует
быстрее и медленнее. Получив эти данные,
ответьте на вопросы исследования.
Вывод:
Подумайте над тем, что произойдет, когда вы спуститесь вниз по столбцу щелочноземельных металлов? Что произойдет, если вы перейдете к первому столбцу периодической таблицы? Вы замечаете закономерность, которая может относиться ко всей структуре периодической таблицы?
Атомы щелочноземельных металлов, находящихся во втором столбце, хуже входят в реакцию с другими веществами, чем щелочные металлы из первого столбца. И чем ниже элемент располагается в столбце, тем сильнее будет проявляться эта закономерность.
Как понять таблицу Менделеева, если ты не шаришь?
 Краткая шпаргалка к Таблице Менделеева
Краткая шпаргалка к Таблице Менделеева
Периодический закон легко применять на практике. Ещё со школы мы все должны знать: натрий похож на калий, фтор похож на хлор, а золото — на серебро и медь. Следующий элемент просто как бы прибавляет к уже существующим ещё что-то.
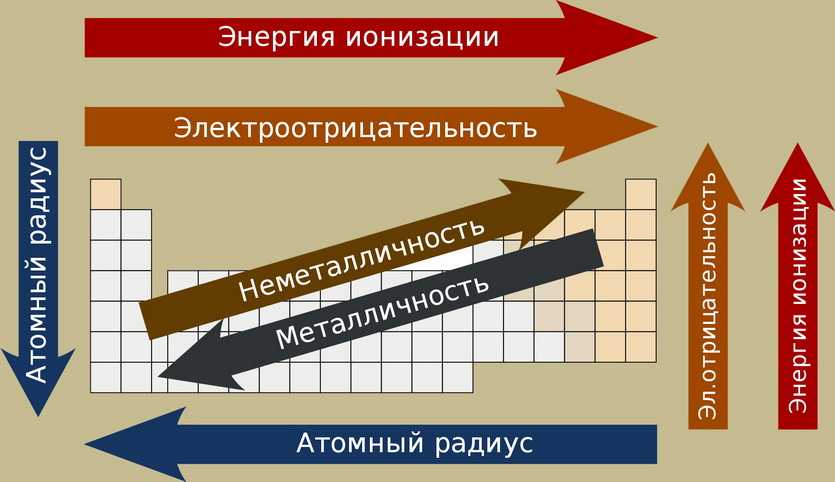
По самой таблице так же можно узнать примерные свойства. В подгруппах сверху вниз:
️ усиливаются металлические свойства и ослабевают неметаллические (появляются свободные электроны — проводит ток);
️ возрастает атомный радиус (выше плотность/масса),
️ возрастает сила образованных элементом оснований и бескислородных кислот (действие сильнее),
️ электроотрицательность падает (хуже соединяется с другими элементами).
В периоде с увеличением порядкового номера элемента:
️ электроотрицательность возрастает (лучше образовывает соединения),
️ металлические свойства убывают, неметаллические возрастают (хуже проводит ток),
️ атомный радиус падает (хуже создает соединения).
Ещё одно свойство связано с традиционной, «короткой» формой таблицы, предложенной самим Менделеевым: если сложить её пополам, посредине IV группы, окажется, что элементы напротив друг друга могут образовывать соединения друг с другом.
Хотя на первый взгляд это не нужно в обыденности, таблица Менделеева помогает быстро понять, например: какая кислота «сильнее», что лучше проводит ток, к чему не стоит прикасаться, чем можно отравиться.
Как быстро и легко выучить таблицу умножения с ребёнком?
Рассмотрим несколько, проверенных личным опытом, практических советов, которые, при применении на практике, дают очень хороший результат.
Совет №1
Большую роль в усвоении таблицы умножения играет понимание смысла умножения. Объясните ребёнку смысл действия умножения и научите этим пользоваться при вычислениях.
Умножение – это сумма одинаковых слагаемых.
8 умножить на 3 – это значит, что число 8 мы должны взять 3 раза: 8 х 3 = 8 + 8 + 8
Понимая смысл умножения, ребёнок сможет найти результат даже в ситуации, когда он забыл какой-то случай из таблицы.
Например, забыв результат умножения числа 4 на 8, можно заменить умножение сложением и найти произведение: 4 х 8 = 4 + 4 + 4 + 4 + 4 + 4 + 4 + 4 = 32.
Важно знать переместительное свойство умножения (от перестановки множителей произведение не меняется), тогда результат можно найти ещё быстрее: 4 х 8 = 8 х 4 = 8 + 8 + 8 + 8 = 32
Умножать можно с помощью рук
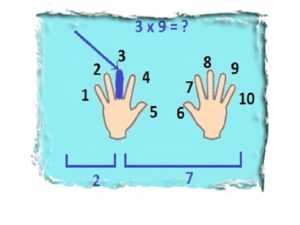
Умножение на 9
Для этого положите руки ладонями вверх, пальцы разогните. Мысленно пронумеруйте пальцы слева направо от 1 до 10. Загните тот палец, на какое число нужно умножить 9. Например, нужно 9х3. Загибаете 3 палец. Все пальцы слева (их 2 — это десятки), пальцы справа (их 7) — единицы. Соединяем десятки и единицы, получаем — 27.
Вычисление произведения любых однозначных чисел больше, чем 5
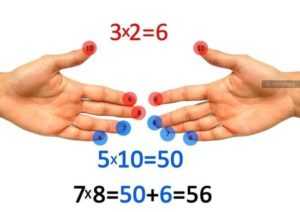
Способ 1
Пронумеруйте мысленно пальцы на обеих руках. Мизинец — 6, безымянный — 7, средний — 8, указательный — 9, большой — 10 (на то он и БОЛЬШОЙ, чтобы выражать самое БОЛЬШОЕ число).
Допустим, вы хотите узнать, сколько будет 8 х 7. Соедините вместе средний палец левой руки (8) с безымянным правой (7), как показано на рисунке. А теперь считайте. Два соединённых пальца плюс те, что под ними, указывают на количество десятков в произведении. В данном случае — 5. Число пальцев, оказавшихся над одним из сомкнутых пальцев, умножьте другим сомкнутым пальцем. В нашем случае 2 х 3 = 6. Это — число единиц в искомом произведении. Десятки складываем с единицами, и ответ готов — 56.
Способ 2
Например, нужно умножить 7х7. Загнём на левой руке столько пальцев, на сколько первый множитель больше 5, а на правой руке столько пальцев, на сколько второй множитель больше 5.
В данном случае будет загнуто по 2 пальца. Если сложить количество загнутых пальцев и перемножить количество не загнутых, то получится соответственно число десятков и единиц искомого произведения, т.е. 49. Если этим способом вычислять произведение 6х7, то получится 3 десятка и 12 единиц, т.е. 30+12=42
Проверьте и убедитесь, что эти способы действительно работают.
Совет № 3
Знание правил умножения упростит запоминание таблицы умножения:
- При умножении любого числа на 1 получается то число, которое умножали.
- Все результаты умножения на 10 начинаются с числа, которое мы умножаем, а заканчиваются на 0.
- Все результаты умножения на 5 заканчиваются на 5 или 0: если умножали нечётное число – на 5, если чётное – на 0.
- Чтобы умножать на 4, можно просто дважды удваивать число. Например, чтобы умножить 6 на 4, нужно удвоить 6 два раза: 6 + 6 = 12, 12 + 12 = 24.
- При умножении на 9, запишите ряд ответов в столбик: 09, 18, 27, 36, 45, 54, 63, 72, 81, 90. Запомнить нужно первое и последнее число. Все остальные можно воспроизвести по правилу: первая цифра в двузначном числе увеличивается на 1, а вторая уменьшается на 1.
Научиться пользоваться таблицей Пифагора
Необходимо показать ребёнку, что числа из левого столбика умножаются на числа из верхней строки. Найти результат очень просто: нужно только провести рукой по таблице вниз и вправо от множителей до места пересечения, где и будет расположен результат умножения.
Возьмите пустую распечатанную или нарисованную таблицу и заполните её вместе с ребёнком. Причем в цвете, закрашивая одинаковый результат одним цветом. Сразу будет видна закономерность. Ребёнок увидит, что запоминать нужно только половину таблицы (согласно переместительному закону умножения).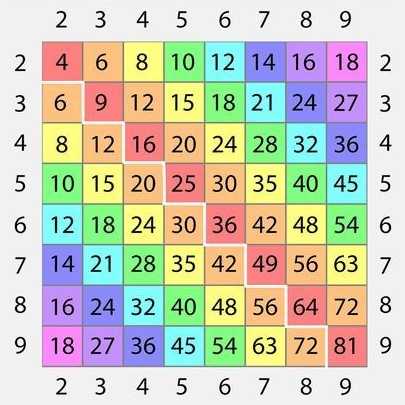
Понимая смысл умножения, можно использовать для вычислений предыдущие или последующие табличные случаи. При этом случае нужно лишь вычесть или прибавить нужное число.
Металлы, металлоиды и неметаллы
По своим физико-химическим свойствам все элементы можно разделить на три основные категории — металлы, металлоиды и неметаллы.
Металлы — это как правило блестящие высоко теплопроводные твёрдые вещества способные плавиться при нагревании и образовывать друг с другом сплавы, а так же образовывать ионные и ковалентные соединения с неметаллами.
Неметаллы — это как правило бесцветные либо цветные твёрдые, жидкие или газообразные вещества. Неметаллые образуют соединения друг с другом при помощи ковалентных связей.
Металлоиды — это вещества, которые могут проявлять в определенных условиях как металлические свойства, так и неметаллические.
Металлы и неметаллы могут быть дополнительно классифицированы на подкатегории, которые видны в таблице в строках слева направо. Так металлы подразделяются на химически очень активные щелочные металлы, чуть менее активные щелочно-земельные, характерные переходные металлы и химически достаточно инертные постпереходные металлы.
Неметаллы подразделяются на многоатомные неметаллы, при этом они ближе к металлоидам т.к. иногда проявляют металлические свойства, на галогениды и инертные газы. Доля неметаллов среди всех элементов небольшая — их 19 из 118 известных элементов.
На самом же деле такое подразделение даже внутри каждой категории весьма условно и на этих условных границах есть большое «перекрытие». Например, бериллий относится к щелочно-земельным элементам, но его амфотерность и склонность образовывать ковалентные соединения позволяют относить его к постпереходным металлам. Радон относится к благородным газам, но образует ряд ионных соединений характерных для металлов. Поэтому существуют и другие типы разделения элементов на группы, например, по минералогическим признакам или кристаллическим структурам соединений.
Вместо заключения
Учитель химии всегда может заинтересовать своим предметом учеников, чтобы вызвать желание учить свой предмет. Вот один из примеров того, как это делают некоторые талантливые педагоги.
Периодическая система в интерпретации Пушкина
«О периодической системе мы начинаем свой рассказ. На ней мы видим только знаки, но если лучше посмотреть, вообразить, свое добавить, то можно многое узреть. Идем направо — фтор, хлор находим, налево — литий, натрий к нам бежит. Там чудеса, там кадмий бродит, аргентум в клеточке лежит. Там на неведомых дорожках следы оставил сер Титан. — там на курьих ножках, прижался к барию лантан. Там Цезий царь над златом чахнет. Там серный дух, там серой пахнет.»
Как быстро выучить таблицу Менделеева – актуальный вопрос, как для учащихся профильных лицеев или ВУЗов, так и для обычных школьников. Особенно перед сдачей экзамена пробелы в знаниях требуют срочной реабилитации. Можно ли в кратчайшие сроки запомнить все названия элементов, а главное понять их свойства? Немного времени, усилий и творческий подход сделают трудную задачу вполне разрешимой.
Краткая история мнемотехники
Если бы наша память была настолько совершенной, что мы могли бы запоминать информацию в неограниченном объёме, ни к чему было бы придумывать письменность и изобретать цифровые носители информации. Знания до сих пор передавались бы из уст в уста.
И именно так они и передавалась долгое время, развивая искусство мнемотехники среди мыслителей и поэтов прошлого. Если бы не техники запоминания, «по дороге» были бы утеряны многие научные знания, произведения народного творчества и такие шедевры мирового искусства, как «Илиада» и «Одиссея».
Считается, что слово с корнем «мнемо» ввёл Пифагор в VI до н. э., соединив его значение с богиней памяти Мнемозиной. Так появился термин «мнемоника» — искусство запоминания, а позже — «мнемотехника». В Древней Греции также использовали мнемотехнику в качестве интеллектуального спорта — демонстрировали искусство запоминать большие объёмы информации (часто бессмысленной) перед аудиторией.
Умение пользоваться своей памятью считалось правилом хорошего тона. Трудно представить себе Цицерона, читающего «по бумажке» блестящую речь. Мнемотехникой владели Аристотель и Пифагор, Юлий Цезарь и Никола Тесла, Джордано Бруно и Наполеон. Многие не просто умели ею мастерски пользоваться, но и излагали методики запоминания в трактатах и книгах.
Развитие технологий тиражирования и передачи знаний во многом было связано с потребностью человечества фиксировать их на более надёжном носителе, чем «горстка нейронов». Так стало возможным массовое образование.
Но как это ни парадоксально, именно сейчас, в век Интернета и мобильных устройств, вопрос применения памяти вернулся к нам с ещё большей актуальностью. Чтобы научиться управлять процессом запоминания в лавинообразном потоке информации, нам на помощь снова приходит старая добрая мнемотехника, которая прекрасно зарекомендовала себя на протяжении 2,5 тысяч лет.
Как выучить таблицу Менделеева: начало пути
Ни для кого не секрет, что повторение – мать учения. Как выучить таблицу Менделеева, если ученик не возвращается к ней снова и снова? Обязательно следует распечатать материал и везде носить его с собой. Повторять элементы необходимо каждый раз, когда возникает свободное время (в очереди, в транспорте, на перемене).
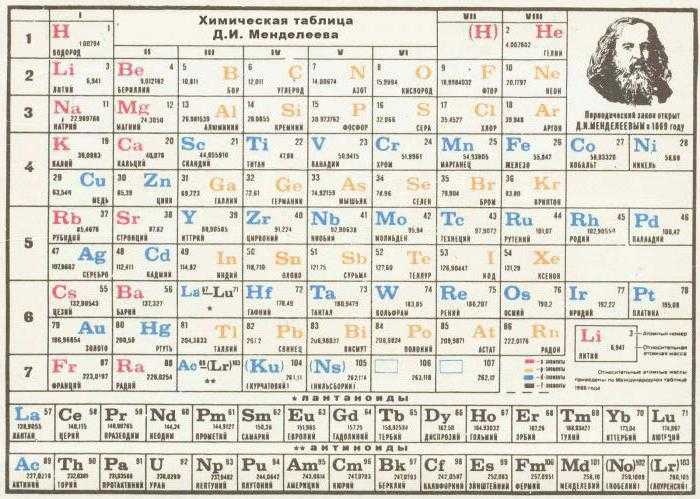
Еще более эффективный вариант – создание копии таблицы вручную. Этот способ идеален для школьников, у которых наиболее развита кинестетическая (мышечная) память. Во время переписывания таблицы можно не только выучить некоторые элементы, но и лучше понять ее устройство, что также способствует эффективному запоминанию.
Не стоит ставить недостижимые цели, выучить всю таблицу за день невозможно. Вполне достаточно запоминать несколько элементов в сутки, а затем повторять те, что были изучены ранее.
Игра в ассоциации
Как выучить таблицу Менделеева? Для лучшего запоминания можно подключить ассоциативное мышление. Для каждого элемента необходимо сочинить небольшую историю, причем вовсе не обязательно делать ее серьезной. Не исключено, что смешной рассказ быстрее отложится в памяти. К примеру, Аргентина получила свое название в честь аргентума (серебра), так как первопоселенцы обнаружили много серебра на этой земле.

Не стоит тратить время, сочиняя истории для запоминания простых элементов. С большой вероятностью в памяти уже и так присутствует информация о том, что водород – это H. Лучше сосредоточиться на том, что кажется наиболее сложным.
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения — это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
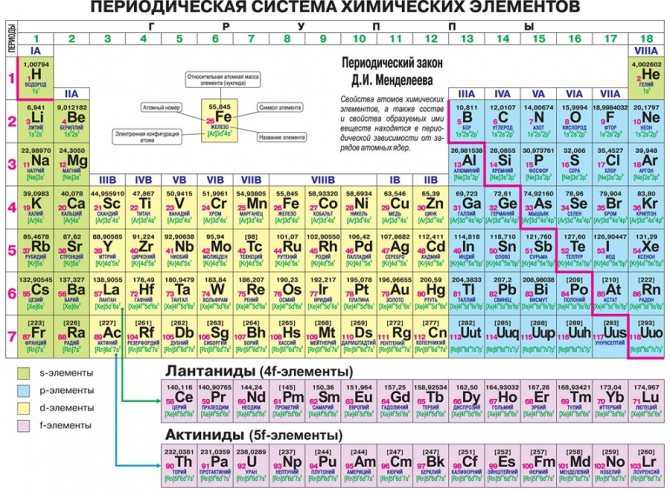
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
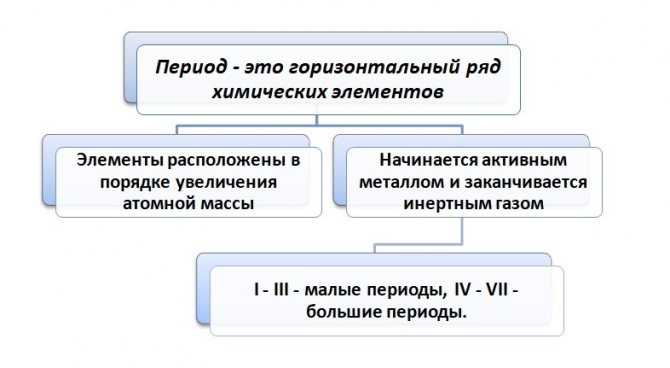
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
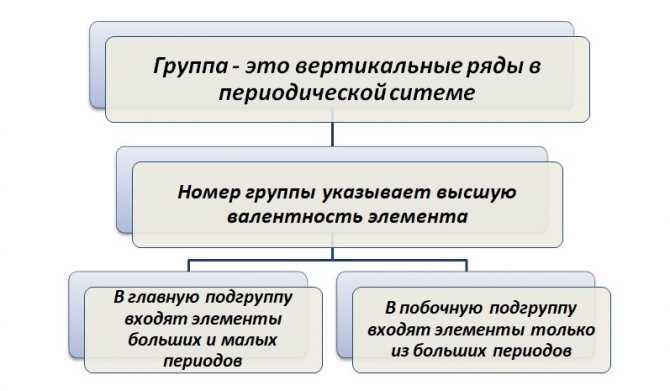
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.

Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах
Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы
Научиться пользоваться таблицей Пифагора
Необходимо показать ребёнку, что числа из левого столбика умножаются на числа из верхней строки. Найти результат очень просто: нужно только провести рукой по таблице вниз и вправо от множителей до места пересечения, где и будет расположен результат умножения.
Возьмите пустую распечатанную или нарисованную таблицу и заполните её вместе с ребёнком. Причем в цвете, закрашивая одинаковый результат одним цветом. Сразу будет видна закономерность. Ребёнок увидит, что запоминать нужно только половину таблицы (согласно переместительному закону умножения).
Понимая смысл умножения, можно использовать для вычислений предыдущие или последующие табличные случаи. При этом случае нужно лишь вычесть или прибавить нужное число.
Совет №5
Использовать шифровки, раскраски, лабиринты…
Подобные задания увлекают ребёнка и облегчают запоминание таблицы умножения.
Математические Шифровки
Использовать шифровки, раскраски, лабиринты…
Подобные задания увлекают ребёнка и облегчают запоминание таблицы умножения.
С чего начать?
Если вспомнить, что и таблица умножения когда-то была не самой простой вещью на свете и знать, с какой стороны подступиться к периодической таблице, то окажется, что выучить ее не просто, а очень просто. Для начала стоит разобраться в механизме работы предложенного метода. Кстати, он универсален: с его помощью можно выучить не только таблицу химических элементов, но и таблицу растворимости, и неправильные глаголы в английском языке.
Прежде всего, ученикам рекомендуется настроиться на позитив. Не стоит впадать в отчаяние, если элементы и их условные обозначения никак не хотят откладываться в сером веществе. Упорно идите к своей цели, и результаты не заставят себя ждать. Не надо бояться, если подобранные предложения кажутся психоделическим бредом. Наоборот, такие абсурдные истории являются раздражителем для мозга и поэтому прочнее заседают в памяти.
Картинки
Как выучить таблицу Менделеева, если не помогают способы, описанные выше? На помощь придут картинки, на которых изображены предметы, часто встречающися в повседневной жизни. Каждый элемент, который необходимо зафиксировать в памяти, должен ассоциироваться с тем или иным рисунком.
Вовсе не обязательно тратить время на рисование картинок. Как быстро выучить таблицу Менделеева? Необходимо распечатать карточки со всеми элементами или создать их вручную, а затем каждый лист прикрепить к конкретному предмету в доме. Скажем, можно «назвать» стол водородом, представить себе, как он превращается в водородную бомбу и взрывается. Также можно вообразить, что у холодильника есть нос, который позволяет ему дышать (кислород). Главное, чтобы образы были яркими и не оказались чересчур сложными.
Тема 4. Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома.
Часть I
1. Открытие Д. И. Менделеевым Периодического закона (ПЗ).
Д. И. Менделеев расположил все известные ему 63 элемента в длинный ряд по возрастанию их Ar и выделил в этом ряду отрезки – периоды, в которых свойства элементов и образованных ими простых веществ изменялись одинаково:
1) металлические свойства ослабевают;
2) неметаллические свойства усиливаются;
3) с. о. в высших оксидах – увеличиваются с +1 до +8;
4) с. о. в летучих водородных соединениях – с -4 до -1;
5) оксиды от основных через амфотерные сменялись кислотными;
6) гидроксиды от щелочей через амфотерные сменялись кислотами.
Д. И. Менделеев сделал вывод – сформулировал Периодический закон: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.Дата: 7 марта 1869 г.
2. ПЗ и строение атома.
Дальнейшие открытия в науке позволили уточнить формулировку ПЗ.1) Было открыто сложное строение атома:
2) Были открыты изотопы – разновидности атомов одного и того же химического элемента с одинаковым числом протонов и разным массовым числом.Например:
Благодаря этим открытиям современная формулировка ПЗ такова: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
3. Периодическая система (ПС) – графическое отображение ПС, поэтому принятая в ней символика соответствует особенностям строения атомов химических элементов.
1) Порядковый номер элемента соответствует заряду ядра, т.е. числу Р+ — протонов в нём. Число других частиц ядра n0 находят по формуле: n0 = A – P+. Число е- в электронной оболочке также соответствует N элемента.
2) Номер периода элемента соответствует числу слоёв или уровней для электронной оболочки атома.
3) Номер А группы соответствует числу электронов на внешнем уровне.
4) Причины изменения свойств элементов объясняются особенностями строения их атомов.
В периодах слева направо — металлические свойства ослабевают, а неметаллические свойства усиливаются, потому что:
а) увеличиваются заряды атомных ядерб) увеличивается число е на внешнем уровнев) число энергических уровней постоянног) радиус атома уменьшается
5) В А группе сверху вниз металлические свойства усиливаются, а не металлические свойства ослабевают, потому что:
а) увеличиваются заряды атомных ядерб) число е на внешнем уровне постояннов) увеличивается число энергетических уровнейг) увеличивается радиус атома
6) Заряд ядра атомов химических элементов возрастает монотонно, а свойства изменяются периодически, потому что свойства химических элементов находятся в периодической зависимости от зарядов ядер.
Открытие ПЗ и создание ПС позволили:
1) исправить неверные Ar некоторых элементов, например: Ar (Ge)2) исправить неверные с. о. некоторых элементов, например: Zn, Al.3) предсказать, описать свойства, указать пути открытия ещё неоткрытых элементов.
Триумф ПЗ для открытия:
-галлий, его химический знак Ga,-кремний, его химический знак Si,-алюминий, его химический знак Al.
4) на основании ПЗ и ПС открыты и созданы новые химические элементы, названы в честь России и русских учёных:
— Менделевий, химический знак Md;
− Флеровий, химический знак Fl;
− Рутений, химический знак Ru.
Часть II
1. Заряд ядра атома железа равен:3) +26
2. Число протонов в атоме ванадия равно:2) 23
3. Число электронных слоёв (энергетических уровней) в электронной оболочке атома соответствует:3) номеру периода
4. Такую же электронную конфигурацию, как у атома аргона, имеет ион:
3) s-2
5. Восемь электронов на внешнем электронном уровне имеет:
6. Число электронов в ионе железа Fe3+ равно:3) 23
7. Верны ли следующие суждения?А. Номер группы соответствует числу валентных электронов на внешнем слое атома для элементов А и В групп.Б. Номер периода соответствует числу электронных слоёв (энергетических уровней) в электронной оболочке атома.1) оба суждения верны.
8. Используя стрелки →(усиление) или ←(ослабление), укажите характер изменения свойств элементов и образованных ими веществ в периодах слева направо.



























